Bonsoir,
Dans votre correction de l'exo 5 du chapitre 6 sur la thermodynamique, vous avez écrit :
ΔH°
r = ΔH°
Comb(C3H6(g)) + (- ΔH° Comb(C3H8O(g))
ΔH°
r = 1 x 500 + (-1 x 300) et donc ΔH°
r = + 200 kJ.mol-1
Mais dans la formule du cours, on a :
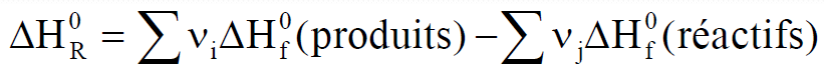
Du coup, on appliquant cette formule avec les enthalpies standard de combustion, on obtient:
ΔH° Comb(C3H8O(g)) = - 300 kJ.mol-1 (car on inverse le sens de la réaction de façon a avoir C3H8O en produit)
ΔH°
Comb(C3H6(g)) = 500 kJ.mol-1
Donc:
ΔH°
r = ΔH° Comb(C3H8O(g)) - ΔH°
Comb(C3H6(g))
ΔH° r = (-300) - 500 = -800 kJ.mol-1
Ce qui ne correspond pas a votre correction. Ai-je fait une erreur de raisonnement ou y a-t-il une erreur dans la correction ?
Merci pour votre reponse,
Wassim ALSRIDI
