MOOC Estimation des incertitudes de mesure en analyse chimique
2. Le concept d'incertitude de mesure
https://sisu.ut.ee/measurement/introduction-concept-measurement-uncertainty
Résumé : Cette section présente les concepts de mesurande, valeur vraie, valeur mesurée, erreur, incertitude de mesure et probabilité.
http://www.uttv.ee/naita?id=17583
|
Let us see now what measurement uncertainty is and then let us see this on an example of a glass of water. Water is the most important liquid in our lives we all drink a lot of water and it is very important that drinking water is healthy, and one part of its healthiness comes from the content of minerals. There are always some small amounts of salts in this water. Many of those salts are even somewhat good for our health but some however are toxic. And if we speak about toxic minerals or toxic salts, we first of all speak about different metal cations. And let us examine the toxic metal lead. There's always some small amount of lead in drinking water but as long as it's small enough it's not really harmful for our health. But it's important that the small level it does not get too high and therefore it’s important to make chemical analysis of water to determine whether it is suitable for drinking or not. So, our measurement in this case is lead content in water and we denote it by C, and we measure it in micrograms per liter. This concentration can assume different values therefore we have here an axis concentration axes and in the in order to make this example more concrete let us also put some real concentration values on this axis. So, this is five, this is six, this is seven micrograms per liter. Now if we again take this glass of water then obviously there's a certain number of lead ions swimming around in this water. Meaning there is some true concentration of lead in this water, and if we were able to count those layered ions, we would know how much they are. Unfortunately, and this is true for almost all analytical chemistry we almost never can really count molecules or atoms meaning the true value will almost always remain unknown for us. And from the point of view of measurement science we can say that the true value is an abstract concept. So even though we are always aiming at the true value with our measurement, we almost never can really achieve it. Let us denote this true value here now. Let's assume it's somewhere here so we call it Ctrue. And according to this scale it's equal to 5.7 micrograms per liter. Now we optimize our measurement procedures in such a way that we would get our measurement result as close to the true value as possible, but we almost never exactly achieve it and we almost never will know if we achieved it or not. So now let us suppose that our measured value in this case happens to be six point one micrograms per litter. Now the difference between the true value and the measured value is called error. And we denote error by Delta, and delta is equal to Cmeasured minus Ctrue. Now, as true value for us is an abstract concept so is also the error because if we would know what the error is then by obviously knowing our measured value, we would be able to calculate the true value, but this is not possible. So unfortunately, people cannot use the concept of error or true value for characterizing the quality of this measured value here. So, what people do instead, they define a range around this measured value and they define this range in such a way that the true value would be within this range with high probability. So, and this range is called uncertainty range. And the half width of this range is called uncertainty. We can be noted by U and in this case the uncertainty is equal to 0.5 micrograms per litter. Now if we have made this measurement and obtained this measurement result and we have made uncertainty estimation taking into account all the uncertainty sources which are influencing the measurement result and we arrived at this uncertainty estimate, we can present our measurement result. And this would look like this. Result, our C is equal 6.1 plus minus 0.5 micrograms per liter. So, instead of trying to give the exact true value or the difference from the true value which we cannot do, we give this range, and this range means that with high probability the true value lies within this range. So, this result tells us to a person that looks at this result that the true value of lead in this water is between 5.6 and 6.6 micrograms per liter. And as we see in this particular case it fully holds because the true value is 5.7 It would be fair to ask why am I speaking about high probability, why don't I say that the true value certainly lies within region? We will see later on that almost never we can present uncertainty in such a way that it embraces the true value with 100% probability. Almost always uncertainty presentation is probabilistic. We will see later on that this way of writing is actually not enough if we want to correctly present measurement result, but that will come later and for the moment this way of presenting the result is for this example sufficient. It is interesting to ask now as we have received this kind of result, can we drink this water or not? Is this level of lead in drinking water in the permissible region or not? The permissible value of lead concentration in drinking water in the European Union is 10 micrograms per liter. We see that 6.1 of course is significantly below 10 but we also must take into account the uncertainty, meaning in principle the true value would also be somewhere higher here. As I said uncertainty range never can have 100 percent probability but it is good to know that probability outside of this range decreases exponentially so that with very high probability the value is within this range, and if we already would go to 5 to 7 range the probability would be extremely high so that the probability of the true content being somewhere above there is very very low. So that this this water is fully suitable for drinking! |
Regardons maintenant ce que représente l'incertitude de mesure. Regardons ceci sur l'exemple d'un verre d'eau. L'eau est le liquide le plus important pour notre vie, nous buvons énormément d'eau et il est très important que cette eau soit saine. Une partie de sa qualité sanitaire provient du fait qu'elle contient des minéraux. Il y a toujours de petites quantités de sel dans l'eau. La plupart de ces sels sont même nécessaires pour notre santé, mais quelquefois ils sont toxiques. Et si nous parlons de minéraux ou de sels toxiques, nous devons parler des différents cations métalliques. Examinons un métal toxique tel que le plomb. Il y a toujours une petite quantité de plomb dans l'eau de boisson, mais pour autant qu'elle soit suffisamment faible, elle n'est pas toxique pour notre santé. Mais il ne faut pas que ce niveau devienne trop important, et donc il est important de réaliser une analyse chimique de l'eau pour déterminer si elle est acceptable comme boisson ou pas. Ainsi, dans ce cas, notre mesure est la quantité en plomb dans l'eau que nous nommerons C et nous le mesurerons en microgramme par litre. Cette concentration peut prendre différentes valeurs donc nous avons ici un axe : l'axe des concentrations, et dans le but de rendre cet exemple plus concret, nous allons positionner la valeur réelle de la concentration sur cet axe. Nous avons ainsi cinq, six et sept microgrammes par litre. Maintenant, si nous prenons ce verre d'eau il y a évidemment un certain nombre d'ions plomb en suspension dans cette eau. Cela signifie aussi qu'il y a une vraie concentration de plomb dans l'eau et si nous sommes en capacité de compter ces ions, nous pourrions connaitre leur nombre. Malheureusement, et ceci est vrai pour presque toutes les analyses chimiques, nous ne pouvons pas réellement compter les molécules ou atomes, ce qui signifie que la vraie valeur restera quasiment toujours inconnue pour nous. Et du point de vue de la science de la mesure, nous pouvons dire que la valeur vraie est un concept abstrait. Ainsi, même si nous tendons vers la valeur vraie avec nos mesures, nous ne pouvons presque jamais l'atteindre. Plaçons cette valeur vraie. Nous supposerons qu'elle est ici et nous l'appellerons Cvraie (Ctrue). Et sur cette échelle, elle est égale à 5,7 microgrammes par litre. Maintenant, nous optimisons nos procédures de mesure de telle sorte que nous ayons notre résultat de mesure aussi proche que possible de la valeur vraie, mais nous ne pourrons jamais l'atteindre exactement, et nous ne saurons jamais si nous l'atteignons ou pas. Maintenant, supposons que notre valeur mesurée soit égale à 6,1 microgrammes par litre. La différence entre la valeur vraie et la valeur mesurée est appelée erreur. Et nous désignerons cette erreur par Delta et Delta est égal à Cmesurée moins Cvraie. Maintenant, comme la valeur vraie est un concept abstrait, l'erreur l'est aussi parce que si nous connaissions la valeur de l'erreur, alors en connaissant la valeur mesurée, nous serions à même de calculer la valeur vraie. Mais ce n'est pas possible. Malheureusement, on ne pourra pas utiliser le concept d'erreur ou de valeur vraie pour caractériser la qualité de la valeur mesurée ici. Ainsi, ce que les gens font à la place, ils définissent une étendue autour de la valeur mesurée, et ils définissent une étendue de telle sorte que la valeur vraie se trouve dans cette étendue avec une grande probabilité. Ainsi, cette étendue est appelée étendue d'incertitude. La demi-largeur de cette étendue est appelée incertitude. Nous pouvons la noter U et, dans ce cas, l'incertitude est égale à 0,5 microgramme par litre. Si nous avons réalisé cette mesure et obtenu un résultat de mesure, et si nous avons réalisé une estimation de l'incertitude en tenant compte de toutes les sources d'incertitude qui influencent le résultat de la mesure et que nous arrivions à une valeur de l'incertitude, nous pourrons présenter notre résultat de mesure. Et il ressemblera à ceci. Résultat : C est égale à 6,1 0.5 microgramme par litre. Ainsi, plutôt que d'essayer de donner la valeur exacte de la valeur vraie ou la différence entre la valeur vraie ce que nous ne pouvons faire, nous donnons une étendue et cette étendue signifie, qu'avec une grande probabilité, la valeur vraie est dans cette étendue. Ainsi, ce résultat signifie que pour une personne qui regarde ce résultat, que la valeur vraie du plomb dans l'eau est comprise entre 5,6 et 6,6 microgrammes par litre. Et comme nous pouvons le voir dans ce cas particulier ceci est correct car la valeur vraie est 5,7. Il pourrait être normal de demander pourquoi je parle de grande probabilité et pourquoi je ne dis pas que la valeur vraie est certainement comprise dans cette région. Nous verrons plus tard que nous ne pourrons quasiment jamais donner une incertitude de telle sorte qu'elle contienne la valeur vraie avec une probabilité de 100%, Presque toujours, l'expression de l'incertitude est de type probabiliste. Nous verrons plus tard que cette façon d'écrire n'est pas suffisante si nous voulons présenter correctement le résultat de la mesure, mais ceci sera présenté plus tard et pour le moment cette façon de présenter le résultat et suffisant pour cet exemple. Il est intéressant de se demander maintenant que nous avons reçu ce type de résultat, peut-on boire cette eau ou pas ? Est-ce que ce niveau de plomb dans l'eau est admis dans la région ou pas ? La valeur autorisée de la concentration en plomb dans l'eau de boisson de l'Union Européenne est de 10 mg/L. Nous voyons que 6,1 est bien significativement inférieur à 10 mais nous devons tenir compte de l'incertitude, ce qui signifie en principe que la valeur vraie pourrait être plus grande ici. Comme je l'ai dit, l'étendue de l'incertitude ne peut pas avoir une probabilité de 100% mais il faut savoir que la probabilité hors de cette étendue décroit exponentiellement. Et ainsi, avec une très grande probabilité la valeur vraie est à l'intérieur de cette étendue qui va de 5 à 7. Cette probabilité étant très importante, la probabilité que la vraie valeur de la concentration soit quelque part plus grande est très très faible. Ainsi, cette eau est totalement buvable ! |
La mesure est un processus permettant d'obtenir expérimentalement la valeur d'une quantité. La quantité que nous avons l'intention de mesurer s'appelle le mesurande. En chimie, le mesurande est généralement la quantité de matière ou la concentration d'une entité chimique (molécule, élément, ion, etc.) dans un objet. L'entité chimique à déterminer est appelée analyte. Les mesures chimiques peuvent être, par exemple, la concentration de plomb dans un échantillon d’eau, la teneur en pesticide du thiabendazole dans une orange ou la teneur en matière grasse dans une bouteille de lait. Dans l'exemple précédent, le plomb (élément), l'acide ascorbique (molécule) et le tissu adipeux (groupe de molécules différentes) sont les analytes. L'eau, l'orange et le lait sont des objets d'analyse (ou des échantillons prélevés à partir d'objets d'analyse).
En principe, le but d’une mesure est d’obtenir la vraie valeur du mesurande. Tous les efforts sont faits pour optimiser la procédure de mesure (procédure d'analyse chimique ou procédure d'analyse) de manière à ce que la valeur mesurée soit aussi proche que possible de la valeur réelle. Cependant, notre résultat de mesure ne sera qu'une estimation de la valeur réelle et la valeur réelle restera (presque) toujours inconnue de nous. Par conséquent, nous ne pouvons pas savoir exactement à quel point notre valeur mesurée est proche de la valeur réelle - notre estimation comporte toujours une certaine incertitude.
La différence entre la valeur mesurée et la valeur vraie est appelée erreur. Une erreur peut avoir un signe positif ou négatif. L’erreur peut être considérée comme composée de deux parties - l’erreur aléatoire et l’erreur systématique - qui seront traitées plus en détail dans les prochains chapitres. Comme la valeur vraie, l'erreur nous est inconnue. Par conséquent, elle ne peut pas être utilisée dans la pratique pour caractériser la qualité de notre résultat de mesure, son accord avec la valeur réelle.
La qualité du résultat de mesure est caractérisée par l’incertitude de mesure (ou simplement l’incertitude), qui définit un intervalle autour de la valeur mesurée CMEASURED, où la valeur vraie CTRUE se situe avec une certaine probabilité. L'incertitude de mesure U elle-même est la demi-largeur de cet intervalle et est toujours non négative. Le schéma suivant (similaire à celui de la vidéo) illustre ceci :
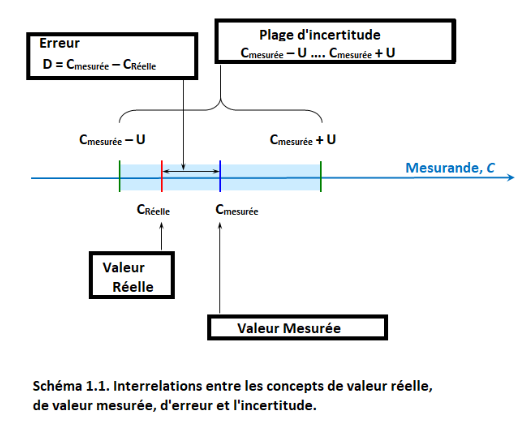
L’incertitude de mesure est toujours associée à une probabilité - comme on le verra dans les prochains chapitres, il n’est généralement pas possible de définir l’intervalle d’incertitude de telle sorte que la valeur réelle y soit comprise avec une probabilité de 100%.
L'incertitude de mesure, telle qu'exprimée ici, s'appelle dans un contexte également l'incertitude de mesure absolue. Cela signifie que l'incertitude de mesure est exprimée dans les mêmes unités que le mesurande. Comme nous le verrons dans les cours suivants, il est parfois plus utile d’exprimer l’incertitude de mesure sous la forme d’une incertitude relative de mesure, qui est le rapport entre l’incertitude absolue Uabs et la valeur mesurée y :
 (1.1)
(1.1)
L'incertitude relative est une quantité sans unité, qui est parfois exprimée en pourcentage.
L’incertitude de mesure est différente de l’erreur en ce sens qu’elle n’exprime pas de différence entre deux valeurs et qu’elle n’a pas de signe. Par conséquent, ell ne peut pas être utilisée pour corriger le résultat de la mesure et ne peut pas être considérée comme une estimation de l'erreur car celle-ci a un signe. Au lieu de cela, l’incertitude de mesure peut être considérée comme notre estimation de la différence absolue la plus probable entre la valeur mesurée et la valeur réelle. Avec une probabilité élevée, la différence entre la valeur mesurée et la valeur réelle est en fait inférieure à l'incertitude de mesure. Cependant, il existe une faible probabilité que cette différence puisse être supérieure à l'incertitude de mesure.
Autoévaluation sur cette partie du cours : Test 1
