Expériences de chimie avec Arduino
2. Calorimétrie
Le calorimètre est un appareil destiné à mesurer les échanges de chaleur qui peut se produire entre plusieurs corps, mettre en jeu des changements d'état ou des réactions chimiques. Le calorimètre constitue un système isolé : il n'y a pas d'échange de matière et d'énergie (travail ou chaleur) avec le milieu extérieur. Il existe toutefois des transferts de chaleur entre les différentes parties de l'ensemble calorimétrique (composés objets de l'étude, accessoires et paroi du calorimètre...). Ces transferts sont quantifiés au travers de la capacité thermique du calorimètre.
Un simple thermos peut être utilisé comme calorimètre, dans lequel sera immergée une thermistance étanche permettant de mesurer la température du milieu.


Déterminer la capacité calorifique du calorimètre
Dans le calorimètre, mettre une masse m1 d’eau (103 g) et mesurer la température du système T1 (20,3 °C). Ajouter une masse m2 d’eau chaude (109 g) à la température T2 (83,6 °C) Noter la température finale du système Tf (50,32 °C).
La capacité thermique du calorimètre C (en J.K-1, 74,6 dans l'exemple) s’obtient en supposant le système isolé : ΣQi=0.
Augmentation de la température de l'eau froide Q1 = m1.c.(Tf-T1)
Diminution de la température de l'eau chaude Q2 = m2.c.(Tf-T2)
Calorimètre Q3 = C.(Tf - T1)
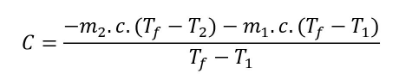

avec une valeur de la capacité thermique massique de l'eau c=4,185 J.g-1.K-1
Plusieurs expériences successivement réalisés ont conduit à une valeur moyenne de la capacité thermique du calorimètre C égale à 73,5 J.K-1
