Expériences de chimie avec Arduino
| Site: | Moodle - Université Claude Bernard Lyon1 |
| Cours: | Arduino - enseignement en chimie |
| Livre: | Expériences de chimie avec Arduino |
| Imprimé par: | Visiteur anonyme |
| Date: | lundi 9 février 2026, 19:13 |
1. Température
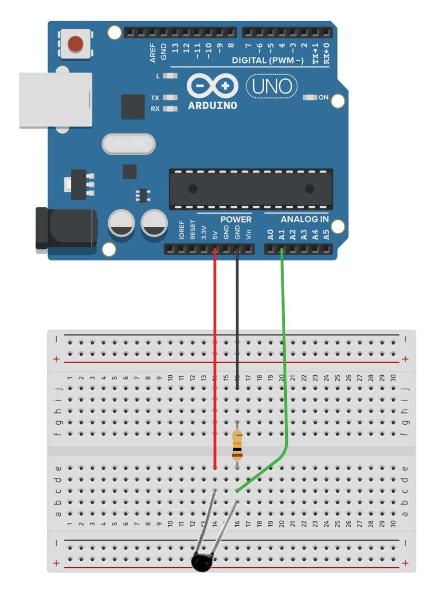
Montage et programme
//Mesure sur thermistance avec résistance 10 kOhm
int PinT1 = A1;
float SMoy; // Moyenne du signal
float alpha = 0.002;
float TempsEntreAffichage = 500;
float TempsAffichageSuivant;
//------------------------------------------------------------------------------
void setup() {
pinMode(PinT1, INPUT);
SMoy = 1.0 * analogRead(PinT1);
Serial.begin(9600);
TempsAffichageSuivant = millis();
}
//------------------------------------------------------------------------------
void loop() {
SMoy = alpha * analogRead(PinT1) + (1 - alpha) * SMoy;
if (millis() > TempsAffichageSuivant) {
float tempC = 1 / ((log((1024.0 / SMoy - 1))) / 3950 + 1 / 298.15) - 273.15;
Serial.print(TempsAffichageSuivant / 1000);
Serial.print(" ");
Serial.println(tempC, 2);
TempsAffichageSuivant = TempsAffichageSuivant + TempsEntreAffichage;
}
}
2. Calorimétrie
Le calorimètre est un appareil destiné à mesurer les échanges de chaleur qui peut se produire entre plusieurs corps, mettre en jeu des changements d'état ou des réactions chimiques. Le calorimètre constitue un système isolé : il n'y a pas d'échange de matière et d'énergie (travail ou chaleur) avec le milieu extérieur. Il existe toutefois des transferts de chaleur entre les différentes parties de l'ensemble calorimétrique (composés objets de l'étude, accessoires et paroi du calorimètre...). Ces transferts sont quantifiés au travers de la capacité thermique du calorimètre.
Un simple thermos peut être utilisé comme calorimètre, dans lequel sera immergée une thermistance étanche permettant de mesurer la température du milieu.


Déterminer la capacité calorifique du calorimètre
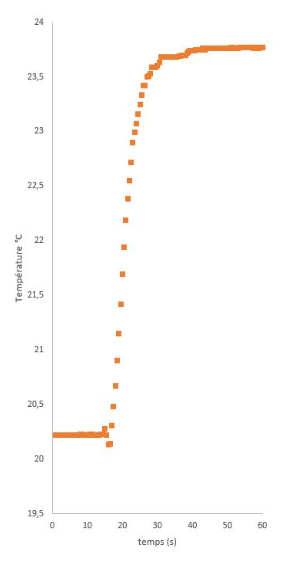
Dans le calorimètre, mettre une masse m1 d’eau (103 g) et mesurer la température du système T1 (20,3 °C). Ajouter une masse m2 d’eau chaude (109 g) à la température T2 (83,6 °C) Noter la température finale du système Tf (50,32 °C).
La capacité thermique du calorimètre C (en J.K-1, 74,6 dans l'exemple) s’obtient en supposant le système isolé : ΣQi=0.
Augmentation de la température de l'eau froide Q1 = m1.c.(Tf-T1)
Diminution de la température de l'eau chaude Q2 = m2.c.(Tf-T2)
Calorimètre Q3 = C.(Tf - T1)
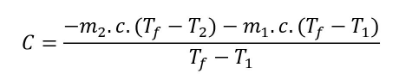

avec une valeur de la capacité thermique massique de l'eau c=4,185 J.g-1.K-1
Plusieurs expériences successivement réalisés ont conduit à une valeur moyenne de la capacité thermique du calorimètre C égale à 73,5 J.K-1
2.1. Chaleur latente de fusion de la glace
La chaleur latente de fusion ΔHfus est l'énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l'état solide à l'état liquide.

Dans le calorimètre, mettre une masse m1 (141,6 g) d’eau. Relever la température initiale T1 (44,92 °C)
Ajouter des glaçons qui auront été préalablement mis en équilibre thermique dans de l'eau (Tglaçon=0°C) puis séchés rapidement sur du papier absorbant (m2 19,36 g).
Agiter pour faire fondre la glace, mesurer la température finale Tf (31,98 °C).
Calculer ΔHfus en supposant le système isolé : ΣQi=0.
Diminution de la température de l'eau Q1 = m1.c.(Tf-T1)
Fusion de la glace et élévation de température de l'eau correspondante : Q2 = m2.ΔHfus + m2.c.(Tf - 0)
Calorimètre Q3 = C.(Tf - T1)
avec c=4,18 J.g-1.°C-1 et pour le calorimètre utilisé C=73,5 J.°C-1.
Pour cette expérience, la résolution de l'équation Q1+Q2+Q3=0 conduit à une valeur de chaleur latente de fusion ΔHfus = 311 J.g-1 (valeur tabulée de la littérature ΔHfus,glace = 334 J.g-1)
2.2. Enthalpie de dissolution
L'enthalpie standard de dissolution ΔrH0diss est la somme de l’opposée de l’enthalpie standard réticulaire (endothermique) et de l’enthalpie standard d’hydratation des ions (exothermique).
La dissolution peut être un phénomène exothermique, athermique ou endothermique.

Dans le calorimètre, mettre une masse m1 (104 g) d’eau. Relever la température initiale T1 (20,13 °C)
Ajouter une masse m2 (quantité de matière n2 mol) de solide (8 g de NaHCO3 soit 0,095 mol) à la même température que l'eau du calorimètre.
Agiter pour solubiliser le solide, mesurer la température finale Tf (16,97 °C).
Calculer Qdiss (1,7 kJ) et ΔrHdiss (18 kJ.mol-1).

Dans le calorimètre, mettre une masse m1 (59 g) d’eau. Relever la température initiale T1 (20,94 °C)
Ajouter une masse m2 (quantité de matière n2 mol) de solide (10 g de NaCl soit 0,17 mol) à la même température que l'eau du calorimètre.
Agiter pour solubiliser le sel, mesurer la température finale Tf (19,27 °C).
Calculer Qdiss (0,60 kJ) et ΔrHdiss (3,5 kJ.mol-1).
Les relations entre les grandeurs
Qdiss = - [C + (m1+m2).c] . (Tf-T1)
ΔrHdiss = Qdiss / n2
Quelques valeurs de référence :
| NaCl | NaHCO3 | Na2CO3 | NaOH | |
|---|---|---|---|---|
| ΔrH0diss (kJ.mol-1) | 3,9 | 17 | -23,4 | -44,5 |
Liste d'enthalpies de dissolution — Wikipédia Cette liste répertorie l'enthalpie de dissolution de quelques substances dans l'eau.
2.3. Dilution et réaction acide/base
Solution commerciale d'acide chlorhydrique : % HCl 23 ; densité 1,11

Dans le calorimètre, mettre une masse m1 (106 g) d’eau. Relever la température initiale T1 (19,8 °C)
Ajouter une masse m2 de la solution d'acide chlorhydrique (49 g soit 0,344 mol) à la même température que l'eau du calorimètre.
Agiter, mesurer la température finale Tf (22,20 °C).
Calculer Qdil (-1,73 kJ)
Solution commerciale de soude : % NaOH 30,5 ; densité 1,33

Dans le calorimètre, mettre une masse m1 (101 g) d’eau. Relever la température initiale T1 (19,58 °C)
Ajouter une masse m2 de la solution de soude (46 g soit 0,466 mol) à la même température que l'eau du calorimètre.
Agiter, mesurer la température finale Tf (22,23 °C).
Calculer Qdil (-1,82 kJ)
Enthalpie de réaction : Mélange de solutions diluées d'acide chlorhydrique et de soude

Dans le calorimètre, mettre une masse m1 (155 g) de la solution diluée d'acide chlorhydrique. Relever la température initiale T1 (21,22 °C)
Ajouter une masse m2 de la solution diluée de soude (147 g) à la même température que l'eau du calorimètre.
Agiter, mesurer la température finale Tf (35,01 °C).
Calculer Qr (-18,4 kJ) et ΔrH (-54 kJ.mol-1).
Réaction H+ + OH- = H2O valeur tabulée ΔrH0 (-56 kJ.mol-1).
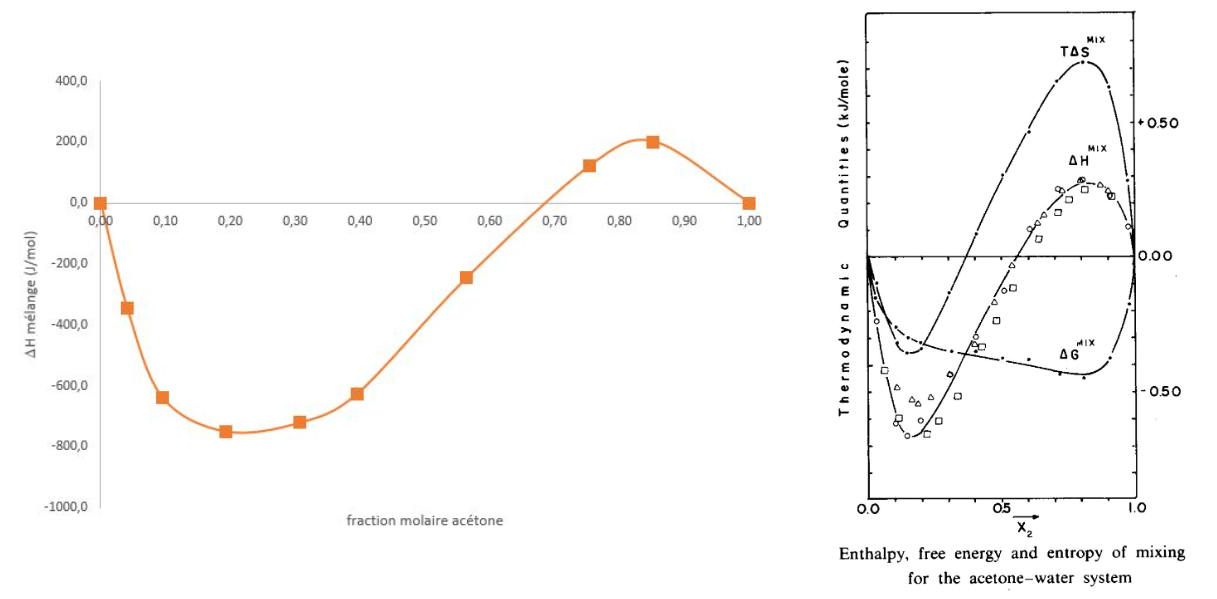
2.4. Mélange Eau - Acétone
Dans le calorimètre, mettre une masse m1 d'eau (64,5 g soit n1 3,58 mol). Relever la température initiale T1 (20,22 °C)
Ajouter une masse m2 d'acétone (8,8 g soit n2 0,15 mol) à la même température que l'eau du calorimètre.
Agiter, mesurer la température finale Tf (23,77 °C).
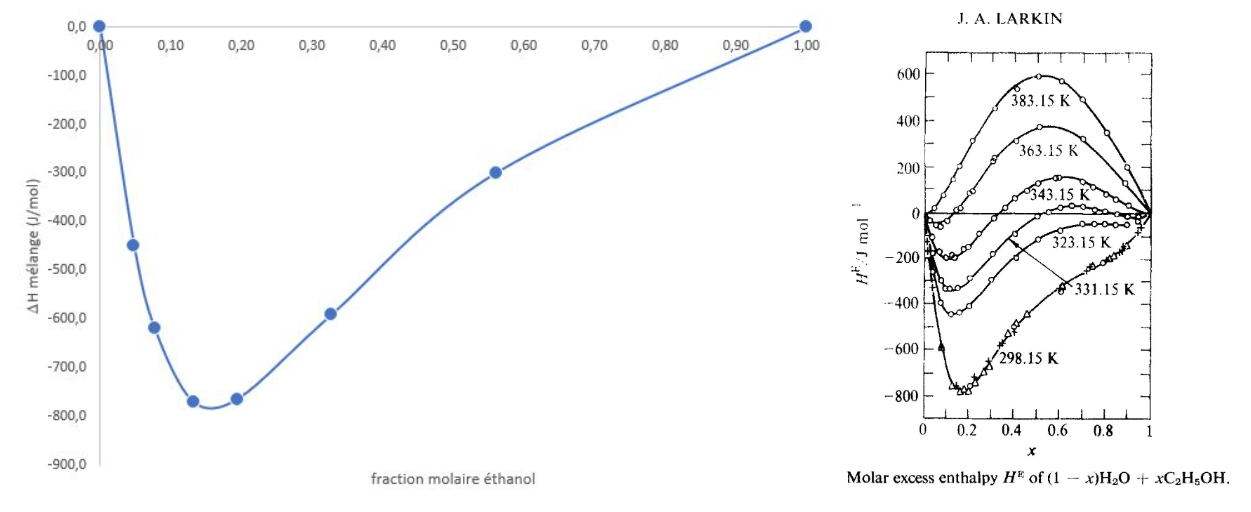
Calculer l'enthalpie de mélange (ΔHmél = -344 J.mol-1) correspondant à la fraction molaire en acétone (xacétone = 0,04).
Données : chaleur massique (J/g/°C) eau 4,18 ; acétone 2,16.
Répéter cette expérience pour différentes valeurs de la fraction molaire en acétone.
Comparer aux résultats obtenus à 298 K par A.V.BENEDETTI et al, Thermochimica Acta 1983, 66 219-233.
2.5. Mélange Eau - Ethanol
Dans le calorimètre, mettre une masse m1 d'eau (62 g). Relever la température initiale T1 (19,98 °C)

Ajouter une masse m2 d'éthanol à 95° (87 g) à la même température que l'eau du calorimètre.
Agiter, mesurer la température finale Tf (25,95 °C).
Calculer l'enthalpie de mélange (ΔHmél = -591 J.mol-1) correspondant à la fraction molaire en éthanol (xéthanol = 0,33).
Données : chaleur massique (J/g/°C) eau 4,18 ; éthanol 2,41.
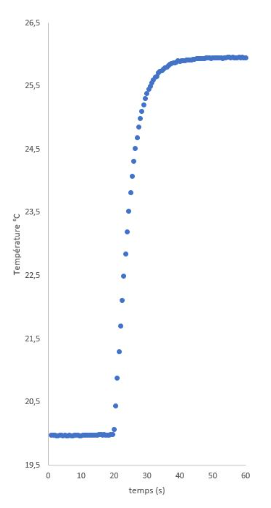
Répéter cette expérience pour différentes valeurs de la fraction molaire en éthanol.
Comparer aux résultats obtenus à 298 K par J.A. Larkin, J. Chem. Thermodynamics 1975, 7 137-148.