MOOC Estimation des incertitudes de mesure en analyse chimique
10. Aperçu des approches d'estimation de l'incertitude de mesure
10.3. Sources d'incertitudes
https://sisu.ut.ee/measurement/93-practical-example
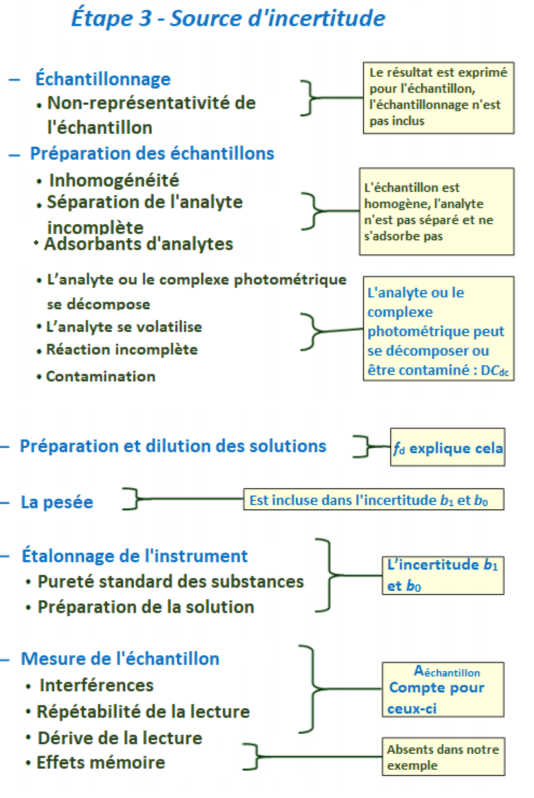
Toutes les sources d'incertitude possibles doivent être prises en compte et celles qui sont susceptibles d'avoir une influence doivent être prises en compte. Les schémas de cette section montrent les sources d'incertitude qui influencent le résultat de cette analyse. Veuillez noter, cependant, que tous ne doivent pas nécessairement être pris en compte individuellement dans l'estimation de l'incertitude. Certains peuvent être petits pour pouvoir être négligés. Certains peuvent être regroupés en une seule composante d'incertitude.
Sources d'incertitudes : en général
http://www.uttv.ee/naita?id=17638
| Let us now look further. The next step is that we should consider and identify all uncertainty sources. And those uncertainty sources that are important that have high weight in our resulting uncertainty those need to be taken into account. And this can be done either individually or by grouping them. And as we will see later on this grouping approach also is used in this example. And importantly each uncertainty source has to be linked with some quantity in the model. So that in fact this input quantity in the model is specifically brought in to link it with certain uncertainty sources which otherwise would remain unaccounted for. And if we discover an important uncertainty source that cannot be linked to any quantity in the model, then we need to modify our model. So that in fact this model that we have here can already be regarded as a modified model. The initial model would be like this and the modification that was added can be seen here. | Allons plus en détail. La prochaine étape est que nous devrions considérer et identifier toutes les sources d'incertitudes. Ces sources d'incertitudes, qui sont importantes et qui ont une grande influence sur nos incertitudes de résultats, sont à prendre en compte. Cela peut se faire individuellement ou en les groupant. Et comme nous le verrons plus tard, cette approche de regroupement est aussi utilisée dans cet exemple. Très important, chaque source d'incertitude doit être reliée à des données dans ce modèle. Donc, cette donnée d'entrée de ce modèle est spécifiquement apportée pour relier cela avec certaines sources d'incertitude qui autrement resteraient non prises en compte. Si l'on découvre une source d'incertitude importante qui ne peut être reliée à aucune donnée de notre modèle, alors nous devons modifier notre modèle. Donc, ce modèle que nous avons ici peut déjà être considéré comme modifié. Le modèle initial serait comme ceci et les modifications qui ont été ajoutées sont visibles ici. |
Sources d'incertitudes : cas par cas
http://www.uttv.ee/naita?id=17639
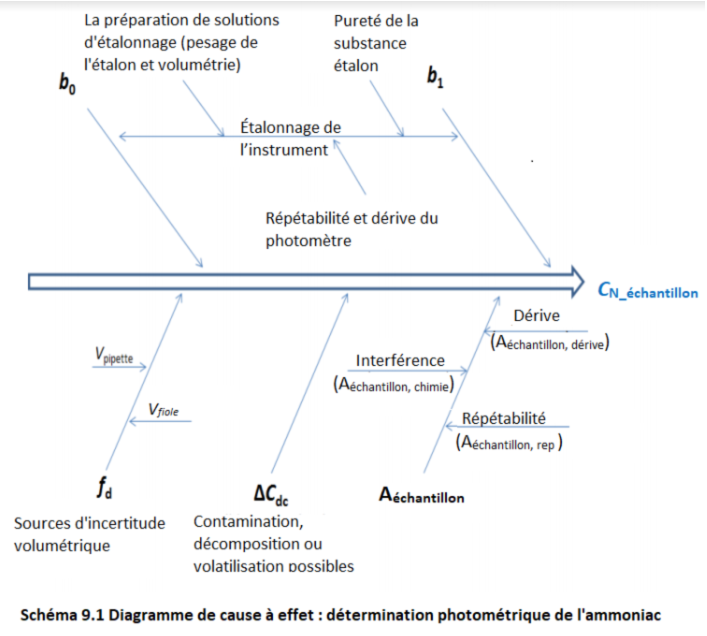
| Let us now look at the uncertainty sources one by one. So I have grouped them on this and the following slide according to the categories of the chemical analysis procedure. And chemical analysis starts with sampling. And since our measurement is only related to the sample not to the overall object then sampling uncertainty for us is not an uncertainty source and we do not need to take it into account. But the next step a very important one is sample preparation. And this has numerous factors that affect it. First of all the sample can be inhomogeneous the analyte separation from the sample can be incomplete and also the analyte can adsorb on the vessel walls. Luckily, in this case we have a homogeneous sample, water sample. We do not separate the analyte from the sample so there's no analyte separation effect and also, ammonium ion does not really adsorb on vessel walls. But the sample preparation has other uncertainty sources which are important. The analyte, or the photometric complex can decompose and this is certainly a factor also in ammonia determination because the photometric complex indeed loses its color with time. The analyte can in principle volatilize, with ammonium it's not very serious but still can happen a little bit. The reaction with the photometric reagent can be incomplete. And this uncertainty source actually is coupled to this one because from the point of view our result, it's not important whether the photometric complex partially decomposed or it did not even for. So these two effects actually have the same effect eventually on the result. And finally, contamination is very much possible with ammonium determination because ammonium is everywhere around us. And all these factors listed here are taken into account by this additional term ∆Cdc which covers the additional factors that can influence the analysis result. And now the next uncertainty sources are listed here. Preparation and dilution of solutions here. It is first of all kept in mind the sample solution and this is accounted for by the dilution factor fd. Then weighing comes into play with preparation of the calibration solutions because the standard substance has to be weigh. The sample we measured by volume a in the case of sample amount weighing and it's not taken into account. And the weighing in the case of calibration craf is taken into account by b1 and b0. Then calibration of the photometer. This has inturn two uncertainty sources : the purity of the standard substance and also the preparation of solutions. And both of these uncertainty sources have again effect on the calibration graph slope Finally, the measurement of the sample itself meaning the photometric measurement with the sample solution. There can be interferences from other components in the sample that also can absorb radiation and that can give us increased results. The repeatability of the reading is of course a factor meaning that if we measure the same solution absorbance several times we get slightly different results. And finally drift of the reading this means that if we measure with some time lag then we can get systematically different results because the property of the spectrophotometer slightly change over time. And all these effects are taken into account by the input quantity Asample, the sample absorbance. And then finally we have here memory effects and memory effects in the case of ammonium determination do not come into play. | Intéressons-nous maintenant aux sources d'incertitudes une à une. Je les ai regroupé ici et sur la diapositive suivante en fonction des catégories des procédures de l'analyse chimique. L'analyse chimique commence avec l'échantillonnage. Puisque la mesure est seulement liée à l'échantillon, pas à l'objet total, alors l'incertitude d'échantillonnage, pour nous, n'est pas une source d'incertitude et nous n'avons pas à la prendre en compte. La prochaine étape très importante est la préparation d'échantillon. Elle a de nombreux facteurs qui affectent l'incertitude. Premièrement, l'échantillon peut être inhomogène, la séparation de l'analyte de l'échantillon peut être incomplète et l'analyte peut s'adsorber sur les parois de la verrerie. Heureusement, dans ce cas, nous avons un échantillon homogène, de type aqueux. Nous n'avons pas à séparer l'analyte de l'échantillon donc il n'y a pas d'effet lié à la séparation de l'analyte et enfin, l'ion ammonium ne s'adsorbe pas vraiment sur les parois de la verrerie. La préparation d'échantillon a d'autres sources d'incertitudes qui sont importantes. L'analyte, ou le complexe photométrique peut se décomposer et c'est biensûr un facteur (d'incertitude) dans la détermination d'ammonium car le complexe photométrique perd de sa couleur avec le temps. L'analyte peut se volatiliser, avec l'ammonium ce n'est pas tellement le cas mais cela peut quand même arriver un peu. La réaction avec le réactif photométrique peut être incomplète. Cette source d'incertitude est enfait couplée avec celle-ci car du point de vue de nos résultats, il n'est pas important que le complexe photométrique se décompose partiellement ou qu'il n'y en ait pas de formé. Ces deux effets, ont enfait le même effet éventuellement sur le résultat. Enfin, la contamination est très plausible avec la détermination d'ammonium car l'ammonium est présent partout. Tous ces facteurs listés ici doivent être pris en compte via ce terme additionnel ∆Cdc qui couvre les facteurs additionnels qui peuvent influencer le résultat de l'analyse. Les prochaines sources d'incertitudes sont listées ici. La préparation et la dilution des solutions ici. Gardez en tête que c'est avant tout la solution échantillon et ceci est comptabilisé par le facteur de dilution fd. La pesée entre aussi en jeu avec la préparation des solutions d'étalonnage car le composé standard doit être pesé. Nous mesurons l'échantillon ici en volume et le cas de la pesée d'échantillon ici n'est pas pris en compte. La pesée, dans le cas du bon étalonnage, est pris en compte par b1 et b0. Ensuite, l'étalonnage du photomètre. Ce dernier possède deux sources internes d'incertitude : la pureté du composé de référence et la préparation des solutions. Ces deux sources d'incertitude ont aussi un effet sur la pente du graphique d'étalonnage. Enfin, la mesure de l'échantillon même, c'est-à-dire la mesure photométrique avec la solution échantillon. Il peut y avoir les interférences des autres composés dans l'échantillon qui peuvent aussi absorber la radiation et nous donner un résultat exagéré. La répétabilité de lecture est biensûr un facteur c'est-à-dire que si nous mesurons la même absorbance pour la solution plusieurs fois, nous obtenons une petite différence dans les résultats. Finalement, la dérive de lecture c'est-à-dire que si nous mesurons avec un temps de décalage alors on peut avoir systématiquement des résultats différents car les propriétés du spectrophotomètre changent un peu dans le temps. Tous ces effets sont pris en compte par la donnée d'entrée Aéchantillon, l'absorbance de l'échantillon. Pour finir, nous avons des effets de mémoire et dans le cas de l'ammonium, ils ne sont pas à prendre en compte. |
Les schémas suivants répertorient les principales sources d'incertitudes dans l'analyse chimique et commentent la présence ou l'absence des sources d'incertitudes respectives dans notre cas. [1]
L'influence des sources d'incertitudes de mesure, regroupées en fonction des grandeurs d'entrée, sur le résultat peut être schématisée sous la forme du diagramme dit «arête de poisson» :
A propos de la modification du modèle
Comme expliqué dans la vidéo, cette équation de modèle,

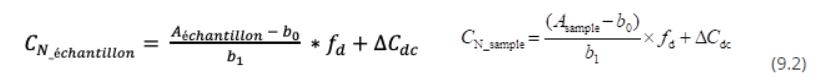
identique à l'équation 9.1 (section 9.2) peut être considérée comme un modèle modifié : le terme ∆Cdc est utilisé pour tenir compte de certaines sources d'incertitudes (décomposition possible, contamination éventuelle). Ce terme est un terme additif , c'est-à-dire que son influence sur C N_échantillon est constante, quelle que soit la valeur de C N_échantillon . La valeur de ∆Cdc est de 0 mg/L et son incertitude exprime l' absolu (c'est-à-dire exprimée en mg/L) incertitude correspondant aux effets possibles de la décomposition et de la contamination. L'intégration de tels termes additifs est une possibilité typique de modifier le modèle pour tenir compte de sources d'incertitudes supplémentaires. Le terme additif convient si l'incertitude supplémentaire n'est pas très sensible à la concentration en analyte (ou si la concentration en analyte ne varie pas beaucoup).
Une autre possibilité typique consiste à introduire un terme multiplicatif (ou facteur multiplicatif ). Dans le cas d'une telle modification, l'équation se présenterait comme suit :
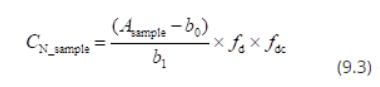
Dans ce cas, la valeur de fdc serait 1 et son incertitude exprimerait l'incertitude relative (c'est-à-dire sans unité) correspondant aux effets possibles de la décomposition et de la contamination. Le terme multiplicatif convient si l'incertitude supplémentaire est à peu près proportionnelle à la concentration en analyte et si la concentration en analyte varie considérablement. Dans le cas des données de cet exemple, la valeur appropriée de u(fdc) serait u(fdc) = u(∆Cdc) / CN_échantillon = 0,019.
***
[1] Commentaire sur l'effet mémoire comme source d'incertitude: l'effet mémoire est problématique tout d'abord dans le cas de l'analyse de traces et ensuite, si l'analyte est spécifiquement sujet à l'adsorption sur des surfaces en verre ou en plastique. Dans ce cas, bien que la concentration d'ammonium dans l'échantillon soit assez faible, il ne s'agit pas encore d'une véritable analyse de traces. L'ion ammonium n'est en aucun cas une espèce fortement adsorbante. Par conséquent, nous pouvons ignorer l'effet de mémoire comme source d'incertitude.